La espectrofotometría es esencial en la investigación y la industria, permite a los científicos determinar con precisión la cantidad de un compuesto en una muestra mediante la absorción de luz. Descubre cómo el espectrofotómetro transforma la luz en conocimiento y revoluciona campos como la química, la biotecnología y la medicina.
Tabla de contenido
Imagina un laboratorio, lleno de destellos de luz, tubos de ensayo y científicos trabajando arduamente. En medio de este escenario se encuentra una pieza clave de la ciencia moderna: el espectrofotómetro. Pero ¿qué hace exactamente y cómo ha llegado a ser tan crucial en la investigación y la industria? Aquí te lo explicamos.
El Viaje de la Luz a través de las Moléculas
Todo comienza con la luz, esa maravilla de la naturaleza que ilumina nuestras vidas y, en este caso, nuestras investigaciones. La espectrofotometría UV-Visible se basa en una premisa fascinante: las moléculas pueden absorber la luz, y la cantidad de luz absorbida es proporcional a la concentración del compuesto en la solución. Este fenómeno permite a los científicos determinar con precisión la cantidad de un compuesto en una muestra.
En un espectrofotómetro, podemos seleccionar la longitud de onda de la luz que pasa a través de una solución y medir cuánta luz es absorbida. Esto se debe a que las moléculas tienen una especie de «firma» única, absorbiendo luz a diferentes longitudes de onda según su estructura y el medio en el que se encuentran. La espectrofotometría UV-Visible, en particular, utiliza radiaciones en las regiones ultravioleta (195-400 nm) y visible (400-780 nm).
La capacidad de las moléculas para absorber energía luminosa es un fenómeno que impulsa ciclos vitales tan esenciales como la fotosíntesis en plantas y bacterias. Cuando la luz es absorbida por una molécula, ésta salta de un estado energético basal a uno excitado. Este salto sólo ocurre si la energía de la luz coincide exactamente con la diferencia de energía entre estos dos estados. Así, cada molécula tiene su propio espectro de absorción, actuando como una huella digital única. En el laboratorio, esta propiedad se convierte en una herramienta poderosa. La espectrofotometría permite identificar y cuantificar biomoléculas en soluciones y muestras biológicas. Usando reactivos específicos que reaccionan con los compuestos a analizar, se forman productos coloreados detectables incluso en muestras complejas.

Aplicaciones que Cambian el Mundo
La espectrofotometría UV-Visible tiene aplicaciones que van más allá del laboratorio, impactando diversas industrias y aspectos de la vida cotidiana:
En la industria alimentaria es usada para el control de calidad de alimentos, determinación de lactosa en bebidas, detección de nitritos en carne, y análisis de componentes como ácido cítrico y fructosa en jugos de frutas. La espectrofotometría UV-Visible también tiene aplicaciones en el control de aguas porque aporta al monitoreo de contaminantes en aguas de consumo y envasadas, detección de amonio, cloro residual, y otros químicos. A su vez, es utilizado en la calidad ambiental dado que permite la evaluación de la demanda bioquímica de oxígeno, medición de fósforo y nitratos en aguas residuales y suelos. De igual forma, la espectrofotometría UV-Visible puede ser incorporada en la industria textil para determinar compuestos químicos en materiales textiles, garantizando la seguridad y calidad de los productos. Finalmente, otra de las aplicaciones que tiene es en la investigación médica porque permite el análisis de concentraciones de sustancias en sangre y otros fluidos corporales, crucial para diagnósticos y estudios clínicos.
Ley de Lambert-Beer: La Fórmula del Conocimiento
El principio de la espectrofotometría se describe con la ley de Lambert-Beer, una fórmula que relaciona la absorbancia de una solución con su concentración y el camino óptico. Esta ley es fundamental para convertir las mediciones de luz en datos cuantitativos, permitiendo a los científicos deducir con precisión la concentración de los compuestos.
La fórmula se expresa como:
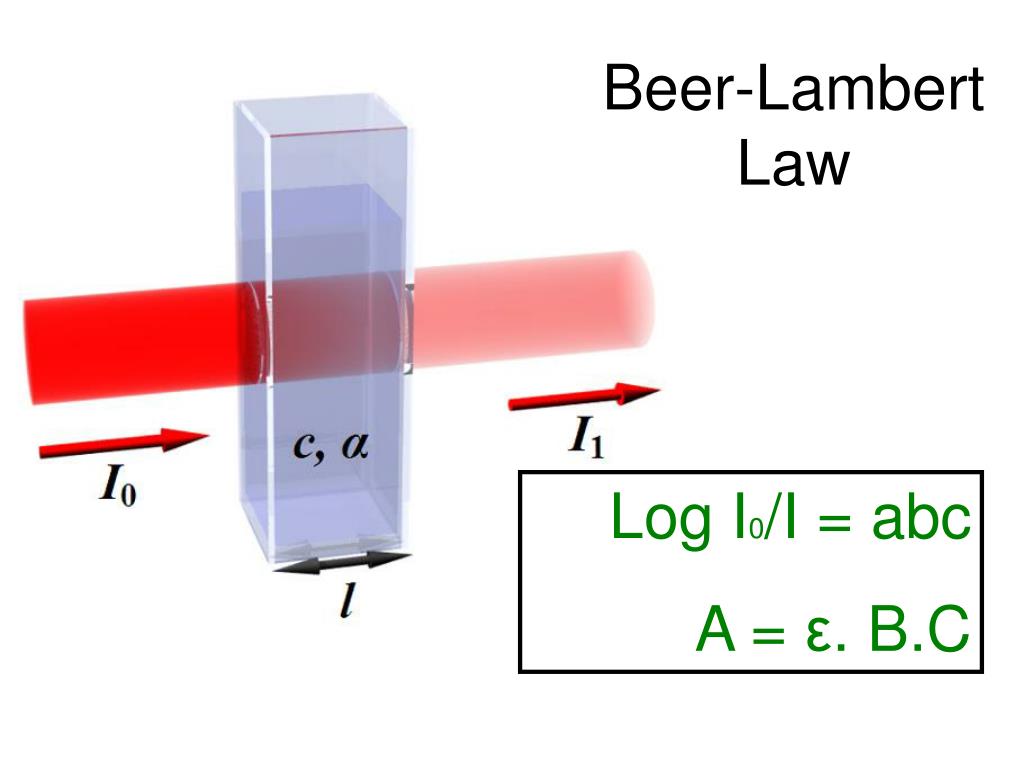
A representa la absorbancia es una medida de la cantidad de luz absorbida por una muestra. No tiene unidades porque es una proporción logarítmica de la intensidad de la luz que pasa a través de la muestra respecto a la luz incidente. Cuanto mayor sea la absorbancia, más luz es absorbida por la muestra. ε es el coeficiente de extinción molar, también conocido como absorbancia molar, es una constante que indica cuánto absorbe una sustancia por unidad de concentración y longitud de camino a una determinada longitud de onda. Se mide en unidades de litros por mol por centímetro (L·mol⁻¹·cm⁻¹). Este coeficiente depende de la naturaleza de la sustancia y la longitud de onda de la luz utilizada en la medición. l es la longitud del camino óptico es la distancia que la luz recorre a través de la muestra, generalmente medida en centímetros (cm). En la práctica, esta longitud es la dimensión interna de la cubeta o el recipiente que contiene la muestra. Un mayor camino óptico incrementa la cantidad de luz absorbida, y por tanto, la absorbancia. Y c es la concentración de sustancia disuelta en un volumen determinado de solución, medida generalmente en moles por litro (mol/L). A mayor concentración de la sustancia, mayor será la absorbancia, ya que hay más moléculas disponibles para absorber la luz.
Exploremos los componentes del espectrofotómetro los cuales son esenciales para realizar las mediciones:
El primer componente es la fuente de luz, como su nombre lo indica, es el encargado de iluminar la muestra con una luz estable y adecuada para el análisis. También tenemos el monocromador, es el encargado de seleccionar la longitud de onda específica de la luz que incidirá en la muestra. Al espacio donde colocamos la muestra a analizar se le conoce como compartimiento de la muestra. Por otra parte, el detector va a captar la luz transmitida o absorbida por la muestra y la convierte en una señal eléctrica. El último componente es el fotodetector, el cual permite mejorar la percepción de la luz y reducen el tiempo de medición. Antes de cada medición, se calibra el espectrofotómetro usando una solución «en blanco» que contiene todos los componentes excepto el compuesto de interés. Esto garantiza que las lecturas sean precisas y sólo reflejen la presencia del compuesto a analizar.
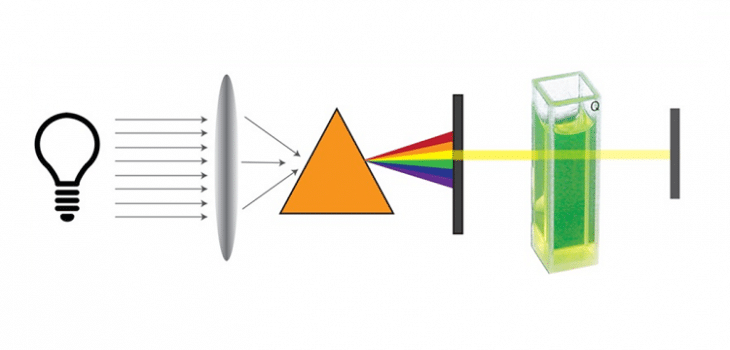
Calibración para información cuantitativa
Para obtener información cuantitativa precisa, necesitas calibrar tu espectrofotómetro. Piensa en esto como ajustar los controles de un telescopio antes de observar las estrellas. La calibración se realiza utilizando soluciones de concentraciones conocidas del compuesto que estás estudiando. Al medir la absorbancia de estas soluciones, puedes crear una curva de calibración que luego te permitirá determinar la concentración de tu muestra desconocida. Para una curva de calibración precisa, necesitarás al menos tres concentraciones, aunque cinco es lo ideal. Estas concentraciones deben abarcar un rango que va desde justo por encima de la concentración estimada de tu muestra desconocida hasta aproximadamente un orden de magnitud menor que la concentración más alta. Utiliza pipetas digitales y matraces volumétricos para preparar tus soluciones con la mayor precisión posible.
Una vez calibrado el instrumento, estarás preparado para medir tus muestras. Al registrar los espectros de absorbancia, obtendrás información valiosa. Por ejemplo, si estás estudiando la degradación de un compuesto, podrás monitorear cómo cambian las absorbancias a lo largo del tiempo, proporcionándote una visión detallada del proceso de degradación. Si la curva de calibración no es precisa (con un coeficiente de correlación menor a 0.9), no te desanimes. Puede ser un error humano en la preparación de las soluciones o un problema con el instrumento, como lámparas que necesitan ser reemplazadas. La precisión y la atención al detalle son clave en este proceso.
Elección de Celdas para Espectrofotometría UV
Para obtener resultados precisos en el rango UV, es crucial utilizar las celdas adecuadas. Las cubetas de cuarzo son la elección recomendada debido a su alta transmitancia en el rango de longitud de onda ultravioleta. El cuarzo es un material transparente a la radiación UV, lo que permite mediciones precisas sin interferencias. Si quieres explorar más sobre los tipos de celdas para espectrofotometría te invitamos a visitar Todo Lo Que Debes Saber Sobre Las Celdas Para Espectrofotómetro.

Desde su invención, el espectrofotómetro ha revolucionado múltiples campos de la ciencia y la industria. Su capacidad para medir la concentración de sustancias en soluciones ha permitido avances en la química analítica, la biotecnología, la medicina, y muchos otros sectores.
La espectrofotometría UV-Visible es una técnica analítica versátil y esencial en muchas áreas científicas e industriales. Así, la próxima vez que veas una botella de jugo de frutas, una muestra de agua potable o un medicamento, recuerda que detrás de cada uno de estos productos, hay un espectrofotómetro y una historia de luz y ciencia trabajando en conjunto.
Extraído de:
- Díaz, A., Ruiz, A., Reyes, E., Cejudo, A., Novo, J., Peinado, J., Meléncez, F., Fiñana, I. (s.f.) Espectrofotometría Espectros de absorción y cuantificación colorimétrica de biomoléculas. https://www.uco.es/dptos/bioquimica-biol-mol/pdfs/08_ESPECTROFOTOMETRIA.pdf
- Ingenierizado.com (s.f.) Espectrofotometría. https://www.ingenierizando.com/optica/espectrofotometria/
- Laboratoris Eyco Ensayos y Calibraciones Ópticas. (2 de junio de 2021) ¿Para qué se utiliza la espectrofotometría UV-VIS y cómo funcionan los equipos de medición? https://www.laboratorioseyco.com/para-que-se-utiliza-la-espectrofotometria-uv-vis-y-como-funcionan-los-equipos-de-medicion/
- Pavan, M., Barron, A. (s.f) Esprectroscopía UV-Visible. Libretexts Espanol. https://shre.ink/D8BM
- Química.es. (s.f.). Espectrofotometría https://www.quimica.es/enciclopedia/Espectrofotometr%C3%ADa.html
